BIBLIOGRAFIA
Wikipedia
Bibliografias.com
Diccionario Purrua
Libro de quimica organica 2
miércoles, 20 de junio de 2012
CONCLUSION
CONCLUSION
Para concluir este proyecto me gusta decir que fue interesante investigar sobre algunos conceptos y compuestos que no sabia que existian y ahora lo se, tambien fue interesante ver que algunas cosas de las que uso y hasta como tienen que ver mucho con estos compuestos. me gusto este ultimo proyecto del año.


Para concluir este proyecto me gusta decir que fue interesante investigar sobre algunos conceptos y compuestos que no sabia que existian y ahora lo se, tambien fue interesante ver que algunas cosas de las que uso y hasta como tienen que ver mucho con estos compuestos. me gusto este ultimo proyecto del año.


¿sabias que?
...un hombre murió al pronunciar 2 etil, 5 metil, 8 butil, 10 docoseno ?
...tú estás formado de carbono, el cual tiene relaciones con tus átomos de hidrógeno, oxígeno y nitrógeno, o sea, que ahora mismo tu cuerpo es como una gran orgía atómica?
...las pastillitas que toma House están hechas con todas las sustancias nombradas en este artículo y otras que aún no se han descubierto?
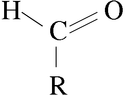
AMINAS
AMINAS
Las aminas son compuestos químicos orgánicos que se consideran como derivados del amoníaco y resultan de la sustitución de los hidrógenos de la molécula por los radicales alquilo. Según se sustituyan uno, dos o tres hidrógenos, las aminas serán primarias, secundarias o terciarias, respectivamente.

PROPIEDADES

El grupo funcional amida es bastante polar, lo que explica que las amidas primarias, excepto la formamida
Sus puntos de ebullición son bastante más altos que los de los ácidos correspondientes, debido a una gran asociación intermolecular a través de enlaces de hidrógeno, entre el oxígeno negativo y los enlaces N—H, mucho más polarizados que en las aminas.
Las aminas son compuestos químicos orgánicos que se consideran como derivados del amoníaco y resultan de la sustitución de los hidrógenos de la molécula por los radicales alquilo. Según se sustituyan uno, dos o tres hidrógenos, las aminas serán primarias, secundarias o terciarias, respectivamente.

PROPIEDADES
Propiedades físicas

El grupo funcional amida es bastante polar, lo que explica que las amidas primarias, excepto la formamida
Sus puntos de ebullición son bastante más altos que los de los ácidos correspondientes, debido a una gran asociación intermolecular a través de enlaces de hidrógeno, entre el oxígeno negativo y los enlaces N—H, mucho más polarizados que en las aminas.
USOS
Las aminas en la química orgánica tienen como principal función ser bases, las cuales pueden ser alifáticas y aromáticas, siendo las alifáticas las más básicas, ya que las aromáticas pueden resonar, deslocalizando el par electrónico del nitrógeno, haciéndo que sea menos probable la reacción ácido-base.
COMPUESTOS:
Anilina:
La anilina se utiliza ampliamente como intermediario en la síntesis de colorantes. También se utiliza en la manufactura de aceleradores de caucho, antioxidantes, productos farmacéuticos, tintas de marcar, tetril, agentes blanqueadores en óptica, reveladores fotográficos, resinas, barnices, perfumes, pulidores de calzado y numerosos productos químicos orgánicos.

Metalamina:
La metilamina se emplea como materia prima de síntesis de muchos otros compuestos comercialmente disponibles, por lo que se fabrican cientos de millones de kilogramos cada año
COMPUESTOS:
Anilina:
La anilina se utiliza ampliamente como intermediario en la síntesis de colorantes. También se utiliza en la manufactura de aceleradores de caucho, antioxidantes, productos farmacéuticos, tintas de marcar, tetril, agentes blanqueadores en óptica, reveladores fotográficos, resinas, barnices, perfumes, pulidores de calzado y numerosos productos químicos orgánicos.

Metalamina:
La metilamina se emplea como materia prima de síntesis de muchos otros compuestos comercialmente disponibles, por lo que se fabrican cientos de millones de kilogramos cada año

ÉSTERES
ÉSTERES
 Los ésteres son compuestos orgánicos derivados de ácidos orgánicos o inorganicos oxigenados en los cuales uno o más protones son sustituidos por grupos orgánicos alquilo (simbolizados por R').
Los ésteres son compuestos orgánicos derivados de ácidos orgánicos o inorganicos oxigenados en los cuales uno o más protones son sustituidos por grupos orgánicos alquilo (simbolizados por R').
 La nomenclatura de los ésteres deriva del ácido carboxílico y el alcohol de los que procede. Así, en el etanoato (acetato) de metilo encontramos dos partes en su nombre:
La nomenclatura de los ésteres deriva del ácido carboxílico y el alcohol de los que procede. Así, en el etanoato (acetato) de metilo encontramos dos partes en su nombre:
PROPIEDADES
Propiedades físicas


 Los ésteres son compuestos orgánicos derivados de ácidos orgánicos o inorganicos oxigenados en los cuales uno o más protones son sustituidos por grupos orgánicos alquilo (simbolizados por R').
Los ésteres son compuestos orgánicos derivados de ácidos orgánicos o inorganicos oxigenados en los cuales uno o más protones son sustituidos por grupos orgánicos alquilo (simbolizados por R').
Nomenclatura
 La nomenclatura de los ésteres deriva del ácido carboxílico y el alcohol de los que procede. Así, en el etanoato (acetato) de metilo encontramos dos partes en su nombre:
La nomenclatura de los ésteres deriva del ácido carboxílico y el alcohol de los que procede. Así, en el etanoato (acetato) de metilo encontramos dos partes en su nombre:- La primera parte del nombre, etanoato (acetato), proviene del ácido etanoico (acético)
- La otra mitad, de metilo, proviene del alcohol metílico (metanol). (ETANOATO DE METILO)
PROPIEDADES
Propiedades físicas
Los ésteres pueden participar en los enlaces de hidrógeno como aceptadores, pero no pueden participar como donadores en este tipo de enlaces, a diferencia de los alcoholes de los que derivan. Esta capacidad de participar en los enlaces de hidrógeno les convierte en más hidrosolubles que los hidrocarburos de los que derivan. Pero las ilimitaciones de sus enlaces de hidrógeno los hace más hidrofóbicos que los alcoholes o ácidos de los que derivan. Esta falta de capacidad de actuar como donador de enlace de hidrógeno ocasiona el que no pueda formar enlaces de hidrógeno entre moléculas de ésteres, lo que los hace más volátiles que un ácido o alcohol de similar peso molecular.
En las reacciones de los ésteres, la cadena se rompe siempre en un enlace sencillo, ya sea entre el oxígeno y el alcohol o R, ya sea entre el oxígeno y el grupo R-CO-, eliminando así el alcohol o uno de sus derivados. La saponificación de los ésteres, llamada así por su analogía con la formación de jabones, es la reacción inversa a la esterificación.
USOS
Muchos ésteres tienen un olor característico, lo que hace que se utilicen ampliamente como sabores y fragancias artificiales.
COMPUESTOS:
ACETATO DE ETILO:
Una de sus principales utilidades es para hacer sistemas de elución para cromatografía en placa fina, aquí, el acetato se mezcla en distinatas proporciones con hexano para obtener el sistema

ACETATO DE ISOAMILO
El principal uso del acetato de isoamilo de aromatizante de ciertos productos como refrescos (en Estados Unidos se elaboran líneas de productos como el Juicy Fruit). Se usa como solvente

ACIDOS CARBOXÍLOS
ACIDOS CARBOXÍLICO
 Los ácidos carboxílicos constituyen un grupo de compuestos que se caracterizan porque poseen un grupo funcional llamado grupo carboxilo o grupo carboxi (–COOH); se produce cuando coinciden sobre el mismo carbono un grupo hidroxilo (-OH) y carbonilo (C=O). Se puede representar como COOH ó CO2H.
Los ácidos carboxílicos constituyen un grupo de compuestos que se caracterizan porque poseen un grupo funcional llamado grupo carboxilo o grupo carboxi (–COOH); se produce cuando coinciden sobre el mismo carbono un grupo hidroxilo (-OH) y carbonilo (C=O). Se puede representar como COOH ó CO2H.
PROPIEDADES
Propiedades físicas
 Los ácidos de masa molar baja (hasta diez átomos de carbono) son líquidos incoloros, de olor muy desagradable. El olor del vinagre se debe al ácido acético; el de la mantequilla rancia al ácido butírico. El ácido caproico se encuentra en el pelo y secreciones del ganado caprino. Los ácidos C5 a C10 poseen olores a “cabra”. El resto sólidos cerosos e inodoros a temperatura ambiente. Sus puntos de fusión y ebullición crecen al aumentar la masa molar.
Los ácidos de masa molar baja (hasta diez átomos de carbono) son líquidos incoloros, de olor muy desagradable. El olor del vinagre se debe al ácido acético; el de la mantequilla rancia al ácido butírico. El ácido caproico se encuentra en el pelo y secreciones del ganado caprino. Los ácidos C5 a C10 poseen olores a “cabra”. El resto sólidos cerosos e inodoros a temperatura ambiente. Sus puntos de fusión y ebullición crecen al aumentar la masa molar.
 Esta ionización se atribuye al desplazamiento electrónico a lo largo del doble enlace del grupo carbonilo hacia el átomo de oxígeno, dejando una carga positiva parcial sobre el átomo de carbono, provocando un desplazamiento inductivo a lo largo de los enlaces C - O y O - H, en sentido opuesto al átomo de hidrógeno, que puede ser extraído por interacción con una base. Por otra parte, el anión producido por la pérdida de un protón es un híbrido de resonancia de dos estructuras canónicas. La deslocalización de la carga estabiliza el anión, por lo que este puede formarse con mayor facilidad Ácidos Carboxílicos
Esta ionización se atribuye al desplazamiento electrónico a lo largo del doble enlace del grupo carbonilo hacia el átomo de oxígeno, dejando una carga positiva parcial sobre el átomo de carbono, provocando un desplazamiento inductivo a lo largo de los enlaces C - O y O - H, en sentido opuesto al átomo de hidrógeno, que puede ser extraído por interacción con una base. Por otra parte, el anión producido por la pérdida de un protón es un híbrido de resonancia de dos estructuras canónicas. La deslocalización de la carga estabiliza el anión, por lo que este puede formarse con mayor facilidad Ácidos Carboxílicos

ACIDO ACÈTICO:
En apicultura es utilizado para el control de las larvas y huevos de las polillas de la cera, enfermedad denominada galleriosis, que destruyen los panales de cera que las abejas melíferas obran para criar o acumular la miel.
Sus aplicaciones en la industria química van muy ligadas a sus ésteres, como son el acetato de vinilo o el acetato de celulosa (base para la fabricación de lalo, rayón, celofán, etc.).
Son ampliamente conocidas sus propiedades como mordiente en soluciones fijadoras, para la preservación de tejidos (histología), donde actúa empíricamente como fijador de nucleoproteínas, y no así de proteínas plasmáticas, ya sean globulares o fibrosas.

 Los ácidos carboxílicos constituyen un grupo de compuestos que se caracterizan porque poseen un grupo funcional llamado grupo carboxilo o grupo carboxi (–COOH); se produce cuando coinciden sobre el mismo carbono un grupo hidroxilo (-OH) y carbonilo (C=O). Se puede representar como COOH ó CO2H.
Los ácidos carboxílicos constituyen un grupo de compuestos que se caracterizan porque poseen un grupo funcional llamado grupo carboxilo o grupo carboxi (–COOH); se produce cuando coinciden sobre el mismo carbono un grupo hidroxilo (-OH) y carbonilo (C=O). Se puede representar como COOH ó CO2H.PROPIEDADES
Propiedades físicas
 Los ácidos de masa molar baja (hasta diez átomos de carbono) son líquidos incoloros, de olor muy desagradable. El olor del vinagre se debe al ácido acético; el de la mantequilla rancia al ácido butírico. El ácido caproico se encuentra en el pelo y secreciones del ganado caprino. Los ácidos C5 a C10 poseen olores a “cabra”. El resto sólidos cerosos e inodoros a temperatura ambiente. Sus puntos de fusión y ebullición crecen al aumentar la masa molar.
Los ácidos de masa molar baja (hasta diez átomos de carbono) son líquidos incoloros, de olor muy desagradable. El olor del vinagre se debe al ácido acético; el de la mantequilla rancia al ácido butírico. El ácido caproico se encuentra en el pelo y secreciones del ganado caprino. Los ácidos C5 a C10 poseen olores a “cabra”. El resto sólidos cerosos e inodoros a temperatura ambiente. Sus puntos de fusión y ebullición crecen al aumentar la masa molar.
Propiedades químicas
La reacción más característica de los ácidos carboxílicos es su ionización
 Esta ionización se atribuye al desplazamiento electrónico a lo largo del doble enlace del grupo carbonilo hacia el átomo de oxígeno, dejando una carga positiva parcial sobre el átomo de carbono, provocando un desplazamiento inductivo a lo largo de los enlaces C - O y O - H, en sentido opuesto al átomo de hidrógeno, que puede ser extraído por interacción con una base. Por otra parte, el anión producido por la pérdida de un protón es un híbrido de resonancia de dos estructuras canónicas. La deslocalización de la carga estabiliza el anión, por lo que este puede formarse con mayor facilidad Ácidos Carboxílicos
Esta ionización se atribuye al desplazamiento electrónico a lo largo del doble enlace del grupo carbonilo hacia el átomo de oxígeno, dejando una carga positiva parcial sobre el átomo de carbono, provocando un desplazamiento inductivo a lo largo de los enlaces C - O y O - H, en sentido opuesto al átomo de hidrógeno, que puede ser extraído por interacción con una base. Por otra parte, el anión producido por la pérdida de un protón es un híbrido de resonancia de dos estructuras canónicas. La deslocalización de la carga estabiliza el anión, por lo que este puede formarse con mayor facilidad Ácidos Carboxílicos
Los ácidos grasos se utilizan para fabricar detergentes biodegradables, lubricantes y espesantes para pinturas. El ácido esteárico se emplea para combinar caucho o hule con otras sustancias, como pigmentos u otros materiales que controlen la flexibilidad de los productos derivados del caucho
COMPUESTOS:
ACIDO FORMICO:
Acción acaricida: En apicultura es utilizado en el cotrol de Varroasis, enfermedad producida por el ácaro ectoparásito del género Varroa, que ataca a las abejas melíferas Apis mellifera y Apis cerana.
Se utiliza en la industria química en tintes.
En la naturaleza se encuentra en el veneno de las hormigas y de las ortigas.
COMPUESTOS:
ACIDO FORMICO:

ACIDO ACÈTICO:

CETONAS
CETONAS
Una cetona es un compuesto orgánico caracterizado por poseer un grupo funcional carbonilo unido a dos átomos de carbono, a diferencia de un aldehído, en donde el grupo carbonilo se encuentra unido al menos a un átomo de hidrógeno.Cuando el grupo funcional carbonilo es el de mayor relevancia en dicho compuesto orgánico, las cetonas se nombran agregando el sufijo -ona al hidrocarburo del cual provienen.También se puede nombrar posponiendo cetona a los radicales a los cuales está unido
 Al hallarse el grupo carbonilo en un carbono secundario son menos reactivas que los aldehídos. Solo pueden ser oxidadas por oxidantes fuertes como el permanganato de potasio dando como productos dos ácidos con menor número de átomos de carbono. Por reducción dan alcoholes secundarios
Al hallarse el grupo carbonilo en un carbono secundario son menos reactivas que los aldehídos. Solo pueden ser oxidadas por oxidantes fuertes como el permanganato de potasio dando como productos dos ácidos con menor número de átomos de carbono. Por reducción dan alcoholes secundarios


BUTANONA:

Una cetona es un compuesto orgánico caracterizado por poseer un grupo funcional carbonilo unido a dos átomos de carbono, a diferencia de un aldehído, en donde el grupo carbonilo se encuentra unido al menos a un átomo de hidrógeno.Cuando el grupo funcional carbonilo es el de mayor relevancia en dicho compuesto orgánico, las cetonas se nombran agregando el sufijo -ona al hidrocarburo del cual provienen.También se puede nombrar posponiendo cetona a los radicales a los cuales está unido
PROPIEDADES
Propiedades físicas
Los compuestos carbonílicos presentan puntos de ebullición más bajos que los alcoholes de su mismo peso molecular. No hay grandes diferencias entre los puntos de ebullición de aldehídos y cetonas de igual peso molecular. Los compuestos carbonílicos de cadena corta son solubles en agua y a medida que aumenta la longitud de la cadena disminuye la solubilidad.Propiedades químicas
 Al hallarse el grupo carbonilo en un carbono secundario son menos reactivas que los aldehídos. Solo pueden ser oxidadas por oxidantes fuertes como el permanganato de potasio dando como productos dos ácidos con menor número de átomos de carbono. Por reducción dan alcoholes secundarios
Al hallarse el grupo carbonilo en un carbono secundario son menos reactivas que los aldehídos. Solo pueden ser oxidadas por oxidantes fuertes como el permanganato de potasio dando como productos dos ácidos con menor número de átomos de carbono. Por reducción dan alcoholes secundarios
USOS
Principalmente, se los usa como solventes organicos. Por ejemple la acetona se usaba como componente de los quitaesmaltes. Ademas, cuando trabajas en laboratorios, se usan como separadores de componentes en extracciones para identificar los componentes de una mezcla. Y tambien son los solventes usados para corridas de HPLC (cromatografias liquidas de alta performance), tambien para identificar componentes de un producto.
COMPUESTOS:
PROPANONA/ACETONA:
Propiedades terapéuticas: es poco usada.
Fue recomendada como anestésico en sustitución del cloroformo.
Como vermífugo.
Antirreumático (uso externo).
COMPUESTOS:
PROPANONA/ACETONA:

BUTANONA:
Se produce en grandes cantidades para su uso en pinturas, adhesivos y otros
acabados porque se evapora rápidamente y se disuelve en muchas sustancias.
También es un producto natural de ciertos árboles y se encuentra en algunas
frutas y vegetales.
ALDEHÍDOS
ALDEHÌDOS
Los aldehídos están presentes en numerosos productos naturales y grandes variedades de ellos son de la propia vida cotidiana. La glucosa por ejemplo existe en una forma abierta que presenta un grupo aldehído. El acetaldehído formado como intermedio en la metabolización se cree responsable en gran medida de los síntomas de la resaca tras la ingesta de bebidas alcohólicas
COMPUESTOS:
Benzaldehìdo:
Aunque se emplea comúnmente como un saborizante alimentario comercial (sabor de almendras) o solvente industrial, el benzaldehído se usa principalmente en la síntesis de otros compuestos orgánicos, que van desde fármacos hasta aditivos de plásticos. Es también un intermediario importante para el procesamiento de perfume y compuestos saborizantes, y en la preparación de ciertos colorantes de anilina.

Metanal:
lo uso en biologia, en laboratorio, como fijador

Los aldehídos son compuestos orgáicos caracterizados por poseer el grup funcional -CHO. Se denominan como los alcoholes correspondientes, cambiando la terminación -ol por -al :
Es decir, el grupo carbonilo C=O está unido a un solo radical orgánico.
PROPIEDADES
PROPIEDADES FISICAS
La doble unión del grupo carbonilo son en parte covalentes y en parte iónicas dado que el grupo carbonilo está polarizado debido al fenómeno de resonancia.
 Los aldehídos con hidrógeno sobre un carbono en posición alfa al grupo carbonilo presentan isomería tautomérica.Los aldehídos se obtienen de la deshidratación de un alcohol primario, se deshidratan con permanganato de potasio, la reacción tiene que ser débil , las cetonas también se obtienen de la deshidratación de un alcohol , pero estas se obtienen de un alcohol secundario e igualmente son deshidratados como permanganato de potasio y se obtienen con una reacción débil , si la reacción del alcohol es fuerte el resultado será un ácido carboxílico.
Los aldehídos con hidrógeno sobre un carbono en posición alfa al grupo carbonilo presentan isomería tautomérica.Los aldehídos se obtienen de la deshidratación de un alcohol primario, se deshidratan con permanganato de potasio, la reacción tiene que ser débil , las cetonas también se obtienen de la deshidratación de un alcohol , pero estas se obtienen de un alcohol secundario e igualmente son deshidratados como permanganato de potasio y se obtienen con una reacción débil , si la reacción del alcohol es fuerte el resultado será un ácido carboxílico.
PROPIEDADES QUIMICAS
Se comportan como reductor, por oxidación el aldehído de ácidos con igual número de átomos de carbono.
USOSLos aldehídos están presentes en numerosos productos naturales y grandes variedades de ellos son de la propia vida cotidiana. La glucosa por ejemplo existe en una forma abierta que presenta un grupo aldehído. El acetaldehído formado como intermedio en la metabolización se cree responsable en gran medida de los síntomas de la resaca tras la ingesta de bebidas alcohólicas
COMPUESTOS:
Benzaldehìdo:
Aunque se emplea comúnmente como un saborizante alimentario comercial (sabor de almendras) o solvente industrial, el benzaldehído se usa principalmente en la síntesis de otros compuestos orgánicos, que van desde fármacos hasta aditivos de plásticos. Es también un intermediario importante para el procesamiento de perfume y compuestos saborizantes, y en la preparación de ciertos colorantes de anilina.

Metanal:
lo uso en biologia, en laboratorio, como fijador
ALCOHOLES
ALCOHOLES
grupos alcoholes.

PROPIEDADES
Propiedades generales
Los alcoholes primarios y secundarios son líquidos incoloros y de olor desagradable, solubles en el agua en cualquier proporción y menos densos que ella. Los terciarios en cambio son todos líquidos.
Su punto de ebullición suele estar en torno a 110 ºC y tiende a aumentar con el número de carbonos. En cuanto al punto de fusión, lo más habitual es que esté por debajo de los -80 ºC.
Propiedades fisicas de los alcoholes:
Las propiedades fisicas de los alcoholes estan relacionados con el grupo -OH, que es muy polar y capaz de establecer puentes de hidrogeno con sus moléculas compañeras, con otras moléculas neutras, y con amiones.
COMPUESTOS:
Metanol:
puede ser utilizado como una fuente de energía limpia está llamando la atención a la industria

Etanol:
Además de usarse con fines culinarios (Bebida alcohólica), el etanol se utiliza ampliamente en muchos sectores industriales y en el sector farmacéutico, como principio activo de algunos medicamentos y cosméticos
Los alcoholes son compuestos orgánicos formados a partir de los
hidrocarburos mediante la sustitución de uno o más grupos
hidroxilo por un número igual de átomos de hidrógeno. El
término se hace también extensivo a diversos productos
sustituidos que tienen carácter neutro y que contienen uno o más

USOS:
Los alcoholes se utilizan como productos químicos intermedios y
disolventes en las industrias de textiles, colorantes, productos
químicos, detergentes, perfumes, alimentos, bebidas, cosméticos,
desnaturalización del alcohol, en productos de limpieza, aceites
y tintas de secado rápido, anticongelantes, agentes espumígenos
y en la flotación de minerales.
PROPIEDADES
Propiedades generales
Los alcoholes primarios y secundarios son líquidos incoloros y de olor desagradable, solubles en el agua en cualquier proporción y menos densos que ella. Los terciarios en cambio son todos líquidos.
Su punto de ebullición suele estar en torno a 110 ºC y tiende a aumentar con el número de carbonos. En cuanto al punto de fusión, lo más habitual es que esté por debajo de los -80 ºC.
Propiedades fisicas de los alcoholes:
Las propiedades fisicas de los alcoholes estan relacionados con el grupo -OH, que es muy polar y capaz de establecer puentes de hidrogeno con sus moléculas compañeras, con otras moléculas neutras, y con amiones.
COMPUESTOS:
Metanol:
puede ser utilizado como una fuente de energía limpia está llamando la atención a la industria

Etanol:
Además de usarse con fines culinarios (Bebida alcohólica), el etanol se utiliza ampliamente en muchos sectores industriales y en el sector farmacéutico, como principio activo de algunos medicamentos y cosméticos
martes, 19 de junio de 2012
HIDROCARBUROS AROMÁTICOS
HIDROCARBUROS
Los hidrocarburos son compuestos de carbono e hidrógeno que, atendiendo a la naturaleza de los enlaces, pueden clasificarse de la siguiente forma:
¦ Saturados ¦ Alcanos
¦ Alifáticos ¦
¦ ¦ ¦ Alquenos
¦ ¦ Insaturados ¦
Hidrocarburos ¦ ¦ Alquinos
¦
¦ Aromáticos
Son los compuestos orgánicos que contienen únicamente carbono e hidrógeno en sus moléculas. Conforman una estructura de carbono a la cual se unen átomos de hidrogeno.
Los hidrocarburos se clasifican en dos clases principales
- Los cuales tienen al menos un anillo aromático (conjunto de seis átomos de carbono)
- Hidrocarburos Alifáticos, se unen en cadenas abiertas, ya sea lineales o ramificadas.
Hidrocarburos Aromáticos
Los Hidrocarburos Alifáticos a su vez se clasifican en:
- Hidrocarburos Saturados, también conocidos como alcanos , los cuales no tienen ningún enlace doble o triple entre los átomos de carbono.
- Hidrocarburos no Saturados, tienen uno o más enlaces dobles o triples entre los átomos de carbono.
- Según los enlaces sean dobles o triples se los clasifica en:
- alquenos : contienen uno o más enlaces dobles
- alquinos : contienen uno o más enlaces triples
- COMPUESTOS:
FENOL:
Industria de materias plásticas (fenoplastos, poliepóxidos, policarbonatos).
Industria de las fibras sintéticas (poliamidas, etc.).
Refinería de petróleos.
Industria farmacéutica.
Industria de las fibras sintéticas (poliamidas, etc.).
Refinería de petróleos.
Industria farmacéutica.
Fabricación de detergentes, pesticidas (principalmente clorofenoles), colorantes, aditivos para aceites, etc.

usa en la producción de cloruro de benzal, alcohol bencílico y benzaldehído. Su uso industrial incluye la manufactura de plásticos, colorantes, tanino sintético, perfumes, resinas y productos farmacéuticos.

ALQUINOS
ALQUINOS
Los alquinos son compuestos que contienen al menos un triple enlace. Con un triple enlace cumplen la fórmula CnH2n-2 con n ≥ 2. Se nombran terminando en -ino el nombre del alcano de igual número de carbonos. La numeración parte del extremo que permite asignar los localizadores más bajos al triple enlace.
Son hidrocarburos de cadena abierta que se caracterizan por tener uno o más triples enlaces, carbono-carbono.
Nomenclatura de alquinos
Los alquinos se nombran sustituyendo la terminación -ano del alcano por -ino. El alquino más pequeño es el etino o acetileno. Se elige como cadena principal la más larga que contenga el triple enlace y se numera de modo que este tome el localizador más bajo posible.
Propiedades físicas
Propiedades químicas
APLICACIÓN EN LA VIDA COTIDIANA Y EN LAS CIENCIAS
El acetileno es un gas que se emplea en la soldadura autogena y que puede alcanzar una temperatura de hasta 3000 ºC, forma con el aire mezclas explosivas; comprimido o licuado es explosivo pero su solución en acetona`puede manejarse con seguridad
Son insolubles en agua, pero bastante solubles en disolventes orgánicos usuales y de baja polaridad: ligroína, éter, benceno, tetracloruro de carbono. Son menos densos que el agua y sus puntos de ebullición muestran el aumento usual con el incremento del número de carbonos y el efecto habitual de ramificación de las cadenas. Los puntos de ebullición son casi los mismos que para los alcanos o alquenos con el mismo esqueleto carbonado.
Los alquinos pueden ser hidrogenados por dar los cis-alquenos correspondientes con hidrógeno en presencia de un catalizador de paladio sobre sulfato de bario o sobre carbonato cálcico parcialmente envenenado con óxido de plomo. Si se utiliza paladio sobre carbón activo el producto obtenido suele ser el alcano correspondiente.
COMPUESTOS:
ETINO O ACETILENO:
Se usa mucho en la soldaduro autogena, y para la produccion de acido acetico.

PROPINO:
Se usa en soldaduras. Es un gas incoloro, de olor característico, más denso que el aire y puede extenderse a ras del suelo. Se descompone al calentarla intensamente y bajo la influencia de presión produciendo monóxido de carbono y dióxido de carbono, causando peligro de incendio o explosión.
Los tres primeros términos son gases; los demás son líquidos o sólidos. A medida que aumenta el peso molecular aumentan la densidad, el punto de fusión y el punto de ebullición..
Suscribirse a:
Entradas (Atom)